|
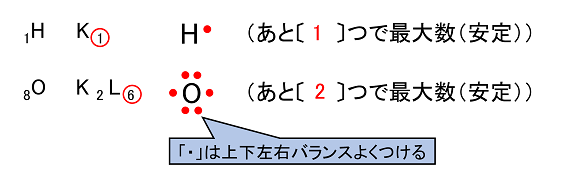
�R�@���q�Ƌ��L�����@ �y�s�Γd�q�Ƌ��L�����z �d�q���@�@ �ŊO�k�d�q���u�E�v�Ō��f�L���̂܂��i�㉺���E�j�ɓY�t��������d�q���Ƃ����B�d�q��2�ő�����C�ɂȂ������̂�d�q�Ƃ����B�܂�1�ő��݂���d�q��s�Γd�q�Ƃ����B�s�Γd�q�͑��̌��q�Ƃ̌����Ɏg���C�s�Γd�q�̐��ɂ��C���̌��f�̐��������܂��B���̐����k�@���q���@�l�Ƃ����B |
|
| ��jH���q��O���q�̓d�q�� | ��jN�iK2L5�j�̌��q�� |
 |
 |
|
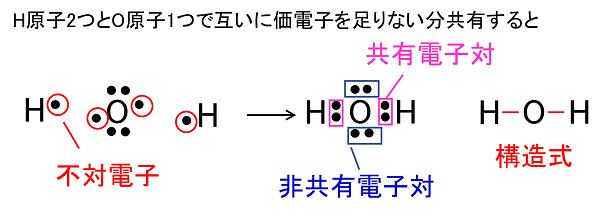
���L�����ƕ��q�@ ������̌��q�ǂ����́C�s�Γd�q���o�������ċ��L�d�q�����邱�Ƃɂ�茋�����C�݂��Ɉ���ȓd�q�z�u�ƂȂ��B���̌��������L�����Ƃ����C���L�����ɂ���Ăł������q�q�Ƃ����B���̂Ƃ��d�q����1�̋��L�d��1�{�̉��W�Ŏ��������w�����\�����ł���B ��jH2O |
|
 |
|
|
����@�������fHCl�C��_���Y�fCO2�C���fN2��d�q���ƍ\�����ŕ\���B |
|
 |
|
|
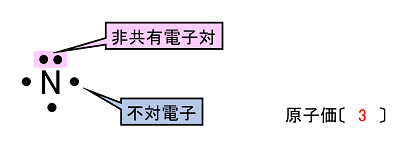
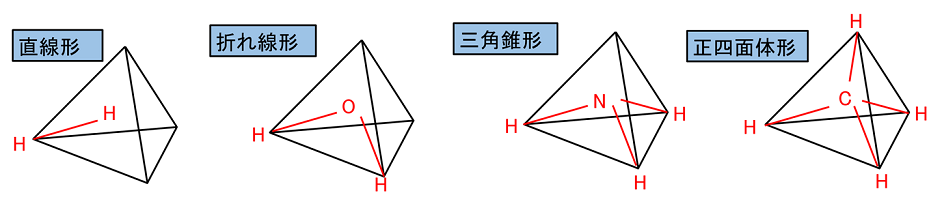
�y���q�̗��̍\���z �@�\�����͕��ʂŎ����Ă���̂ŁC���q�̗��̓I�Ȍ`��\���Ă��Ȃ��B���q���i���q�̎�̐��j�͑�����4�Ȃ̂ŁC���q�͐��l�ʑ̂̒��S���璸�_�Ɍ������Ď���̂��Ă���ƍl�������B���̎�ɑ��̌��q����������̂ŁC�P�����݂̂���Ȃ镪�q�ɂ͎��̂悤�ȗ��̍\�������݂���B |
|
 |
|
| ��d������O�d�������܂ޕ��q�́C�����̕����������^�╽�ʂɂȂ�B �@�@�@�i�y���W�z�����O���ƌ����Q�Ɓj | |
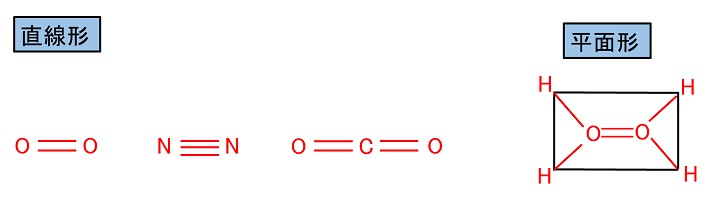 |
|
|
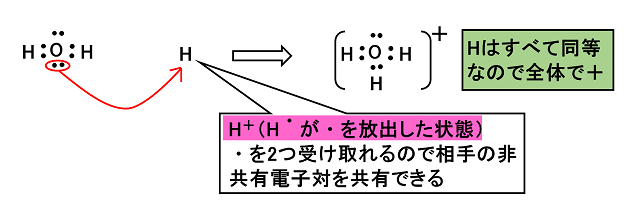
�y�z�ʌ����z �@�ʏ�̋��L�����́C2�̌��q���݂��ɕs�Γd�q���o���C���L���Ăł��錋���ł���B����ɑ��C2�̌��q�ԂŁC����̌��q�����L�d�q�����L���邱�Ƃɂ���Ăł��鋤�L�������k�@�z�ʌ����@�l�Ƃ����B ��1�j�I�L�\�j�E���C�I��H3O�{�ƃA�����j�E���C�I��NH4�{ |
|
| �I�L�\�j�E���C�I��H3O�{ H2O�̔L�d�q��H�{�����L���������` |
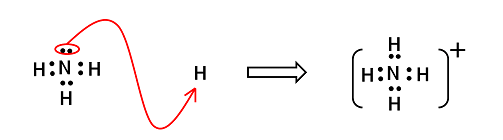
�A�����j�E���C�I��NH4�{�@ |
 |
 |
|
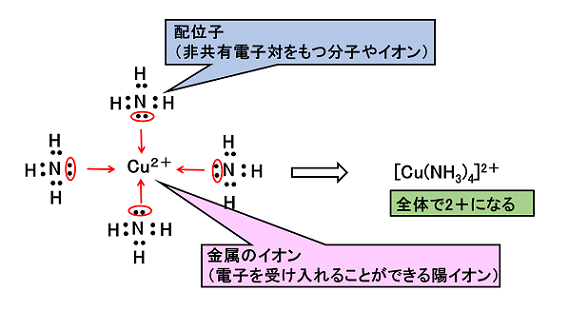
��2�j���C�I�� �@NH3�Ȃǂ̔L�d�q�������q�́C�����̃C�I���ɔz�ʌ������邱�Ƃ��ł���B�����̃C�I���͗z�C�I���i���q���d�q����o���Ăł����C�I���j�Ȃ̂ŁCNH3�Ȃǂ����L�d�q�����L���邱�Ƃ��ł���B���̂Ƃ��ł���C�I�����k�@���C�I���@�l�Ƃ����CNH3�Ȃǂ̕��q���k�@�z�ʎq�@�l�Ƃ����B |
 |
|
�q�Q�l�r �z�ʎq�ɂ́C���q��A�C�I��������C���̂悤�Ȃ��̂�����B H2O�i�A�N�A�j�CNH3�i�A���~���j�COH�|�i�q�h���L�V�h�j�CCN�|�i�V�A�j�h�j�CCl�|�i�N�����h�j �z�ʐ��F�����C�I���ɔz�ʂ���z�ʎq�̐���z�ʐ��Ƃ����C�����C�I���̎�ނɂ̂��قڌ��܂��Ă���B |
|
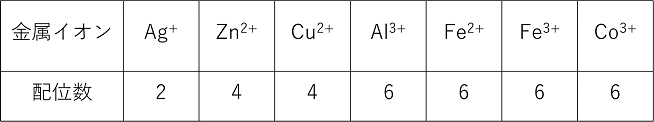 |
|
|
���C�I���̓d�א��F�����C�I���Ɣz�ʎq�̓d�ׂ̘a�ɂȂ�B ���C�I���̌`�F���C�I���̌`�́C���̔z�ʐ��ɂ���Ď��̂悤�Ȍ`���Ƃ�B �����^�i2�z�ʁj�C�����`�i4�z�ʁj�C���l�ʑ́i4�z�ʁj�C�����ʑ́i6�z�ʁj |
|
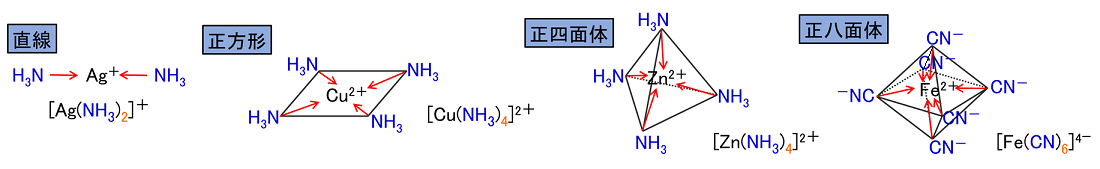 |
|
| ���C�I���̖��� �i�z�ʐ��j�C�i�z�ʎq���j�C�i�������j�C�i�����C�I���̉����j�̏��ŌĂсC�Ō�ɑS�̂��z�C�I���̂Ƃ��́u�C�I���v�C�S�̂��A�C�I���̂Ƃ��́u�_�C�I���v������B�z�ʐ��̓��m�i1�j�C�W�i2�j�C�g���i3�j�C�e�g���i4�j�C�y���^�i5�j�C�w�L�T�i6�j����Ŏ����B |
 |
|
�y�d�C�A���x�Ƌɐ��z �d�C�A���x |
|
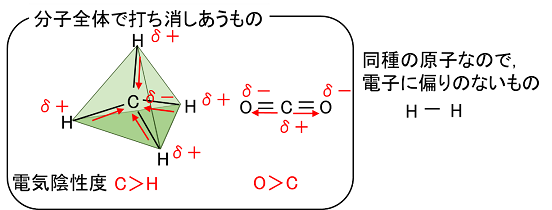
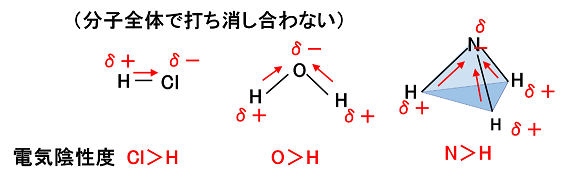
| �@���L�������Ă���2��ނ̌��q�̊Ԃɑ��݂��鋤�L�d�q�́C�ǂ��炩����̌��q�ɂ�������đ��݂��Ă���ꍇ�������B���̂悤�ɁC���L�d�q����������đ��݂���̂́C���L�d�q�������t���鋭�������q�ɂ���ĈقȂ邩��ł���B���̋��L�d�q�������t���鋭���𐔒l�ɂ������̂��k�@�d�C�A���x�@�l�ł���B2��ނ̌��q�̊Ԃɑ��݂��鋤�L�d�q�́C�d�C�A���x�̑傫�Ȍ��q�̕��ɂ�������đ��݂���B��ʂɁC�d�C�A���x�́C�����\�Łk�@��K�X�@�l�������āk�@�E���@�l�Ɉʒu������̂قǁk�@�傫�@�l���Ȃ�X��������B | 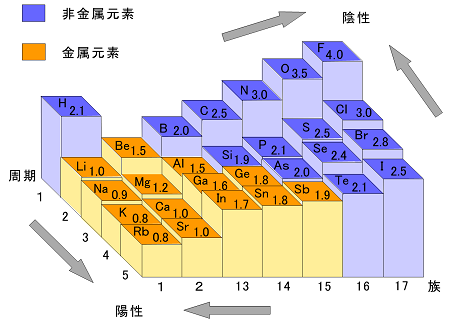 |
|
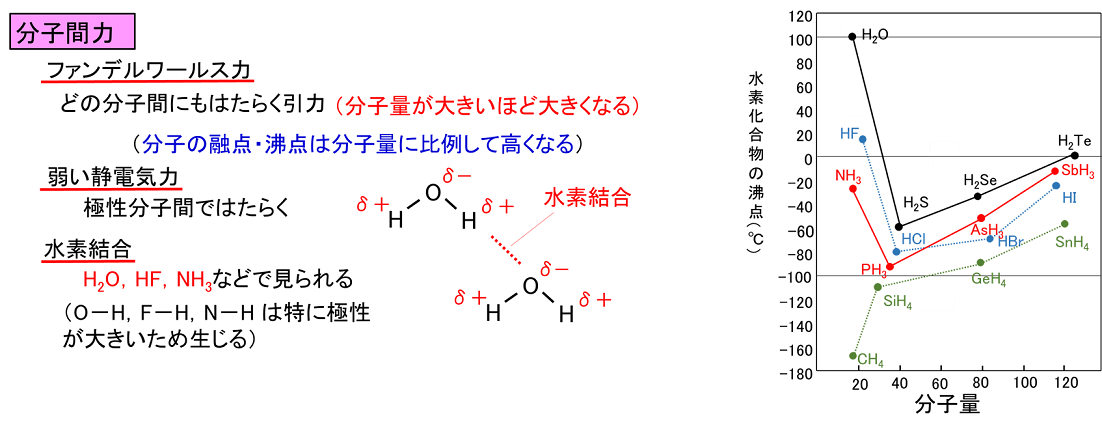
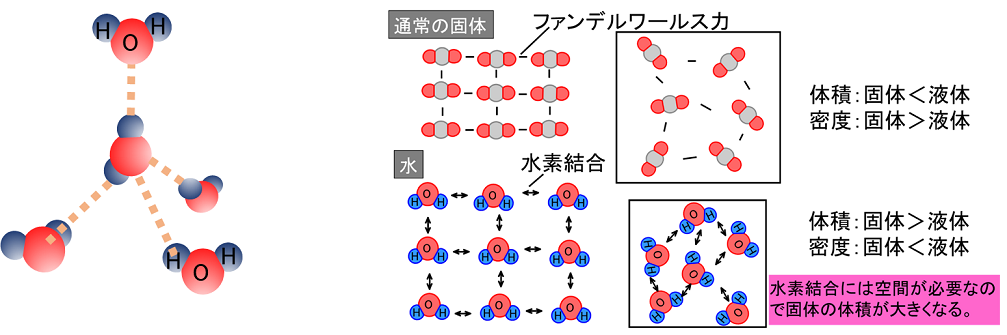
����@���̕��͒��̉��������͐��������C��肩������B �@�@�@�@�����\��17���ɂ����āC�����̔ԍ����傫���قǁC���f�̓d�C�A���x�͑傫���B �@�@�B�@�d�C�A���x�̑傫�����f�قǁC�z�C�I���ɂȂ�₷���B �@�@�C�@2�̌��q�̓d�C�A���x�̍����傫���قǁC�����̋ɐ��͑傫���B �@�@�D�@2�̌��q�̓d�C�A���x�̍����傫���قǁC���L����������₷���B �@�@�@�@��@�@�A�@���@�@�B�@��@�@�C�@���@�@�D�@��@ |
|
| �����̋ɐ� �@ |
 |
|
��jHCl�i�E��j �d�C�A���x��H��Cl�Ȃ̂ŁCH��Cl�̊Ԃ̋��L�d�q�́C�k�@Cl�@�l�̕��ɂ������B�@ |
|
|
|
|